Electronic Trial Master File
Dokumentenmanagementsystem
für klinische Studien
Komplexe Strukturen und arbeitsteilige Prozesse sind charakteristisch für Klinische Studien. Vor allem die regulatorisch konforme Dokumentation von Aktivitäten, Ereignissen und Ergebnissen im Trial Master File (TMF) ist eine Herausforderung: Es geht um sehr viele und sehr heterogene Dokumente. Die DHC VISION eTMF-Lösung ermöglicht eine verlässliche Strukturierung und Klassifizierung der gesamten Dokumentation entsprechend der Good Clinical Practice (GCP).
Eine Klinische Studie überprüft die Leistung, Wirksamkeit und Sicherheit von Medizinprodukten, Behandlungsformen, Wirkstoffen etc. und wird mit Patienten oder Probanden durchgeführt. Die GCP – Good Clinical Practice – definiert einen international anerkannten und nach ethischen und wissenschaftlichen Gesichtspunkten aufgestellten Standard für Planung, Durchführung, Monitoring/Auditierung, Dokumentation, Auswertung und Berichterstattung für Klinische Studien.
Das Trial Master File (TMF) ist eine Sammlung von Dokumenten aus einer klinischen Studie. Im TMF sind alle wesentlichen Akten der Studie zusammengefasst. Das TMF stellt die Integrität der klinischen Daten und die Compliance zur GCP sicher. Allerdings stellen Audits immer wieder gravierende Schwachstellen bei der regulatorisch konformen und nachvollziehbaren Dokumentation von Studien fest: Das TMF ist lückenhaft, nicht immer aktuell, und Dokumente werden am Studienende nicht an einem Ort konsolidiert. Verzögerungen bei der Zulassung von Wirkstoffen und Medizinprodukten oder gar ein Scheitern von Studien sind die häufige Folge.
Eindrucksvolle Funktionalität
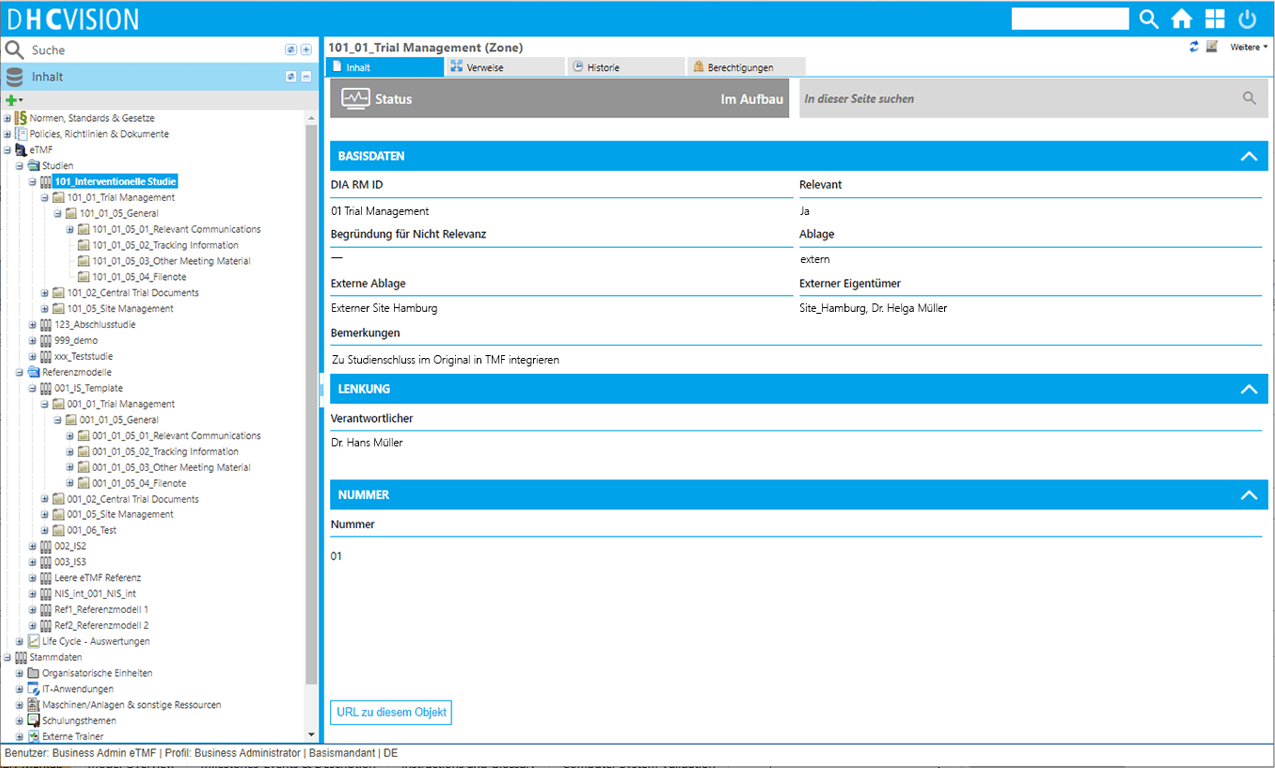
Studienverwaltung
- Digitale Dokumentenverwaltung nach dem Referenzmodell der Drug Information Association (DIA)
- Vorlagen-basierte Anlage und flexible Konfiguration von Einzelstudien
- Einfache Strukturierung von TMFs für einzelne Studien
- Differenziertes Rollen- und Berechtigungskonzept für Studien und Studiendokumente
- Flexible Steuerung von Zugriffen auf Ablagestrukturen und Einzeldokumente
- Übersichtliche und auditierbare Ablage von Dokumenten in Einzelstudien
- Komfortabler Import und einfache Klassifizierung von Dokumenten
- Sichere Erstellung, Prüfung und Freigabe von Dokumenten im System
- Bereitstellung gängiger Dokumenttypen gem. DIA-Referenzmodell
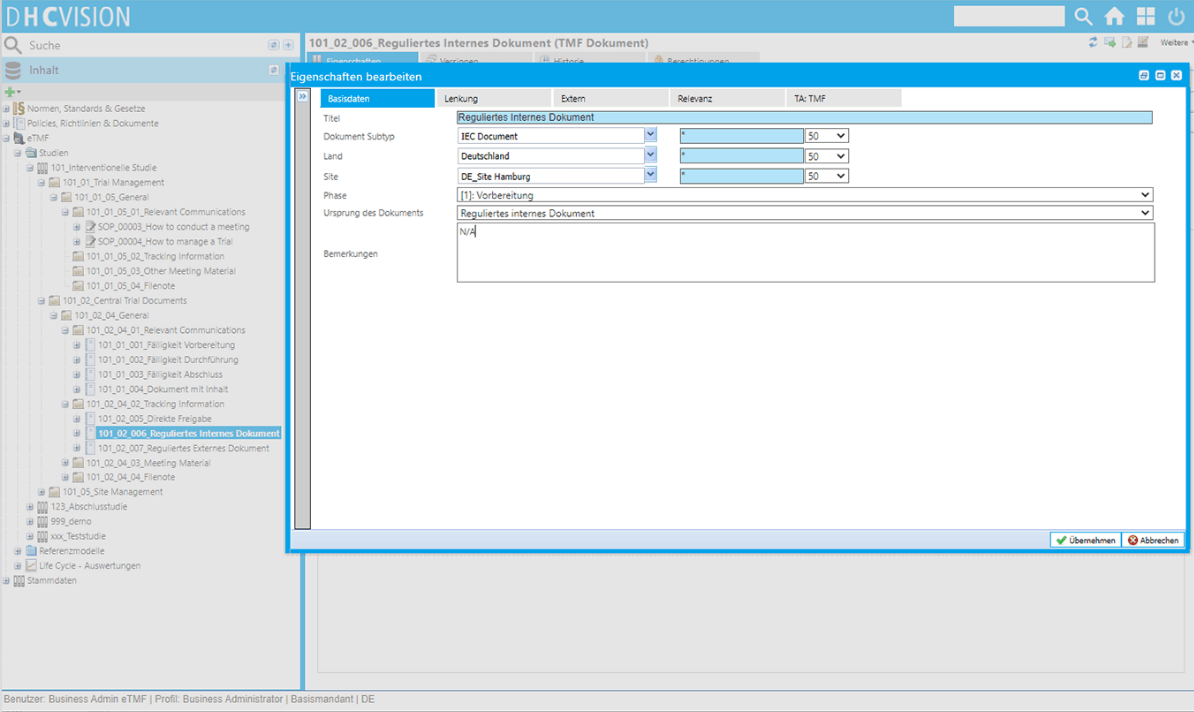
Dokumentenmanagement
- Standardisierung durch über 50 Dokumentvorlagen und Workflows
- Flexible Kodierung von Dokumenten
- Elektronische Signaturen konform 21 CFR Part 11
- Statusmanagement
- Kommentarfunktion und -dokument im Workflow zur Kommunikation
- Systemgestützte Berechnung von Gültigkeit und Archivdauer
- Zielgruppengenaue Verteilung bei neuen / geänderten Dokumenten
- Verteilung zur Information oder Kenntnisnahme (Personen, Gruppen)
- Versand von Nachrichten per Mail und in die persönliche Taskbox
- Echtzeit-Publikation
- Einfache und flexible Anpassung von Freigabe-Workflows
- Aufgabenverteilung in die persönliche Taskübersicht sowie per E-Mail
- Systematische Verfahren zur Außerkraftsetzung, Gültigkeitsverlängerung, Reaktivierung und Archivierung von Dokumenten
Dokumentenüberwachung
- Umfassende Berichte zur Überwachung
- Volle Nachvollziehbarkeit und Kontrolle im Management von Dokumenten
- Durchgängige Änderungs- und Versionshistorie von Dokumenten
- Hochperformante Cognitive Search
- Umfassende Suchmechanismen mit Filter-/Selektierungsfunktionen
- Erinnerungs-/Eskalationsmechanismen
- Umfassende Mechanismen zur Statusverfolgung (Tracebility)
- Workflow-Monitoring des Status
- Interaktive Data Analytics und Business Intelligence Funktionen
- Diagnose der aktuellen und zukünftigen Compliance
Factsheet anfordern
Alle Prozesse rund um gelenkte Dokumente und den vollständigen Funktionsumfang haben wir Ihnen kompakt in dem Factsheet zum DHC VISION Electronic Trial Master File zusammengefasst.
„*“ zeigt erforderliche Felder an
Alle Möglichkeiten auf einen Blick
Studien- und Dokumentenverwaltung
- Vollständige Implementierung des DIA-Referenzmodells
- Template-basierte Anlage und Konfiguration von Studien auf Basis des DIA-Referenzmodells
- Verwaltung und Tracking von extern (zum Beispiel bei den Sites) gelagerten Dokumenten
- Einfache Strukturierung von TMFs für einzelne Studien
- Anlage gängiger Typen von Studiendokumenten
- Flexible Steuerung von Zugriffen auf Ablagestrukturen und Einzeldokumente
- Übersichtliche und auditierbare Ablage von Dokumenten in Einzelstudien
- Import, Migration und Klassifizierung von Dokumenten
- Automatisierte Vergabe eindeutiger Dokumentnummern (Präfix)
- Flexible Kodierung von Dokumenten sowie frei definierbare Eigenschaften bzw. Attribute
- Systemgestützte Berechnung von Revisionszyklen und der Archivdauer
- Import von Studiendokumenten
- Integration der Microsoft Office Produkte (Word, Excel, Powerpoint, Outlook)
- Einfache Festlegung von Verantwortlichkeiten, Rollen, Sites, Ländern (aus den Stammdaten)
- Änderung von Dokumenten ausschließlich durch autorisierte Personen
- Vollumfängliche Stammdatenverwaltung
Dokumentenerstellung und -lenkung
- Best-Practice-Workflows u.a. für Bearbeitungs-, Prüfungs- und Freigabeprozesse
- Elektronische Signaturen nach 21 CFR Part 11
- Workflow-basierte Erstellung, Prüfung, Freigabe von Dokumenten
- Systemseitige nachvollziehbare Versionierung aller Dokumente (Versionshistorie)
- Erzeugung neuer Versionen ausschließlich auf Basis aktuell freigegebener/ gültiger Versionen
- Automatische Statusvergabe für Dokumente
- Lenkung durch vordefinierte Workflows und intuitive Festlegung der Workflowteilnehmer
- Definition und Zuweisung von Aufgaben in Dokumentenworkflows
- Benachrichtigungen bei Aufgabenerteilung bzw. -abschluss
- Möglichkeit zu seriellen oder parallelen Prüfungs- und Freigabeumläufen
- Abwesenheitsassistent und Stellvertreter-Regelung
- Studien Lifecycle Management Statusmanagement
- Automatische Statuswechsel bei Dokumenten („in Bearbeitung“, „zur Prüfung“, „zur Freigabe“)
- Automatisiertes Versionsmanagement für Dokumente, inkl. Außerkraftsetzung und Archivierung von Vorversionen
Veröffentlichung
- Automatische Konvertierung von erstellten Dokumenten in PDF
- Echtzeit-Publikation
- Zielgruppenorientierte Informationsverteilung bei neuen oder geänderten Dokumenten
- Verteilung zur Information oder Kenntnisnahme (an Gruppen oder Einzelpersonen)
- Einfache kundenindividuelle Modellierung und Konfiguration von Freigabe-Workflows
- Aufgabenverteilung in persönliche Taskbox und per Mail (inkl. Link zum Dokument)
- Möglichkeit zur Einbindung des DHC VISION Trainingsmanagements
Überprüfung
- Vordefinierte Workflows zur Außerkraftsetzung, Invalidierung, Gültigkeitsverlängerung, Reaktivierung und Archivierung von Dokumenten
- Termin- und zeitraumgesteuerte, zyklische Wiedervorlage von Dokumenten zum Review
- Manuelle, dokumentspezifische Festlegung des Datums zur Wiedervorlage
- Direkter Überarbeitungslauf oder Gültigkeitsverlängerung aus dem Wiedervorlageverfahren
- Erinnerungs- und Eskalationsmechanismen zur Einhaltung von Terminen (Vorlaufzeiten)
- Vollständiger Referenz- und Verwendungsnachweis von Dokumenten
- Unterstützung der Invalidierung von Dokumenten durch autorisierte Personen
- Dynamische Anzeige und einfache Abarbeitung dokumentbezogener Korrekturvorschläge
- Bearbeitung / Überarbeitung neuer Fassungen bei Fortbestand aktuell gültiger Versionen
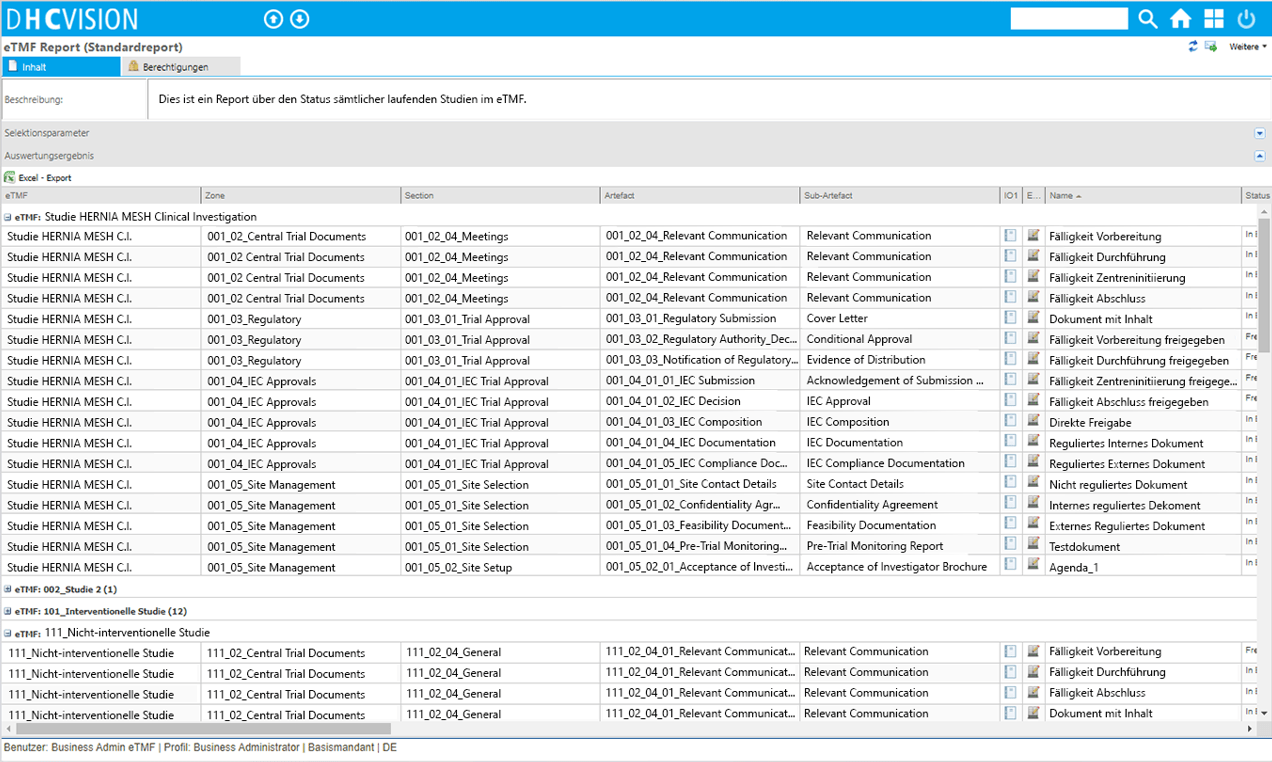
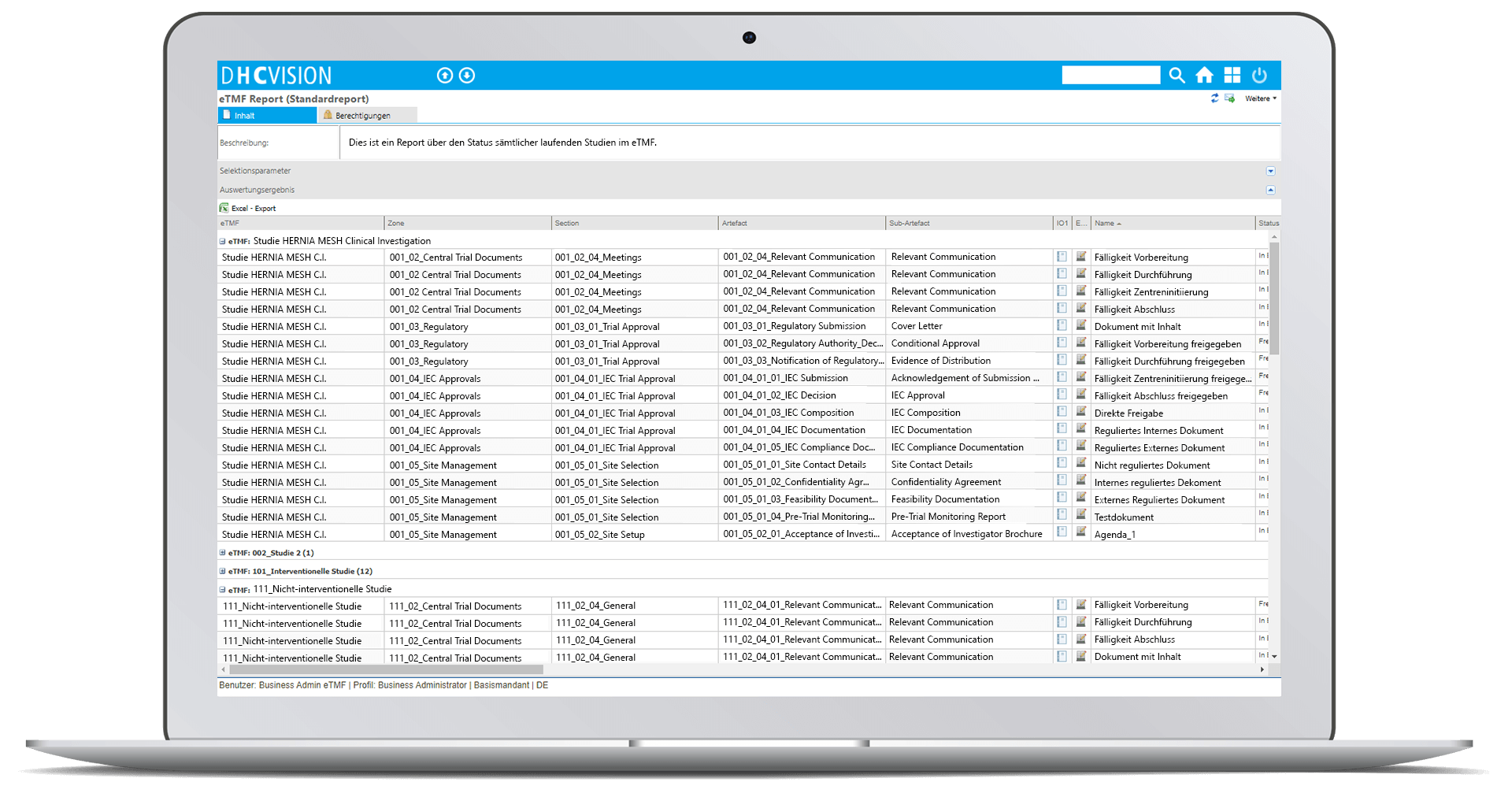
Analytics
- Anzahl der Dokumente im jeweiligen Status und pro Typ
- Overdue Management: Gültigkeit der Dokumente inkl. Statusinformation
- Drilldown bis auf das einzelne Dokument mit Status- und Detailinformationen
- Anzeige der wesentlichen Dokumentattribute bzw. -eigenschaften
- Schnell-Ansicht auf das Einzeldokument inkl. mitgeltender Unterlagen
Reporting
- Hochperformante Cognitive Search
- Umfassenden Suchmechanismen und Filter-/ Selektierungsfunktionen
- Integrierte Volltextsuche über Dokumentinhalte und -attribute
- Weitreichende Auswahl an Selektionsparameter zur Unterstützung einer Vielzahl Use-Cases
- Definierbare Statusberichte und Reports zur Planung von Wiedervorlagen
- Systemgestützte Überwachung der Gültigkeit von Dokumenten
- Erinnerungs-/ Eskalationsmechanismen zur Überwachung begrenzt gültiger Dokumente
- Umfassende Mechanismen zur Statusverfolgung (Tracebility)
- Workflow-Monitoring
Anlagen und Anhänge
- Erstellung von Dokumenten/Informationen als mitgeltende Anlagen oder Zusatzinformation
- Referenzierung auf weitere Dokumente wie Checklisten, Scans, inkl. Mehrfachauswahl
- Verlinkung/ Verweise auf weitere Bezugsobjekte (Prozesse, Sites, Personen, Länder etc.)
- Gezielte Veränderung von Zusatzinfos/Referenzen ohne Einfluss auf das Hauptdokument
- Automatisches Versions- und Statusmanagement
- Intelligentes Benachrichtigungswesen
Ereignisse, Benachrichtigungen, Kommunikation
- Notification Event Modeling Framework zur automatisierten, präzisen und rechtzeitigen Benachrichtigung von Personen, Rollen/Gruppen oder Systemen
- Flexible und ansprechende Gestaltung von Benachrichtigungen (u.a. HTML); auch mehrsprachig, an verschiedene Empfängersysteme und externe Akteure wie Sites
- Regelwerke und Kommunikation durch die Erstellung von Nachrichten entlang rollenbezogener Interessen und Sichten (Benutzer Sicht, organisatorische Sicht, Compliance Sicht).
- Erfassung von Benachrichtigungen im Audit-Trail
- Volle Nachvollziehbarkeit von Informationsereignissen und -Inhalten
Sicherheit
- Revisionssichere Ablage und Verwaltung der Dokumente in frei definierbaren Strukturen
- Vollständige Versions- und Änderungshistorie (Audit Trail)
- Schreibschutz bereits signierter oder freigegebener Dokumente
- 21 CFR Part 11 Konformität (Electronic Records, Electronic Signatures)
- Feingranulares, differenziertes Rollen- und Berechtigungskonzept für Studien und Studiendokumente
- Vordefinierten Rollen, Profilen, Benutzergruppen und -Berechtigungen
- Einhaltung höchster Sicherheitsanforderungen
Integration und Anschlussfähigkeit
- Enge Verzahnung von eTMF und übergreifenden digitalen Compliance-Prozessen
- Anbindung des eTMF an das leistungsstarke Dokumentenmanagement in DHC VISION
- Kombination von Studiendokumentation und Training im DHC VISION Trainingsmanagement
- Zuverlässiger Umgang mit Abweichungen durch Integration von eTMF und Abweichungsmanagement
- Effiziente Verwaltung von Änderungen im DHC VISION Change Management
Validierung und Compliance konsequent im Blick
DHC VISION ist speziell für den Einsatz in hochregulierten Branchen konzipiert. So erfüllt die Lösung technologisch wie auch fachlich (Business Prozesse) die GxP Guidelines und Richtlinien der FDA, EMA, PIC/S oder ICH sowie den 21 CFR Part 11. Zur Validierung des Systems steht das Validation Package bereit. Bestehend aus den Validation Accelerators (vollständiges Dokumentationsset zur Validierung) und den Validation Services zur Anpassung der Dokumentation an Ihre individuelle Situation.
Dazu passende Produkte
SOP CONTROL
Die optimale Lösung zur digitalen Verwaltung und Lenkung Ihrer Vorgabedokumentation. Sicher, kontrolliert, nachvollziehbar und regulatorisch-konform.
TRAINING
Die perfekte und nahtlos integrierbare Ergänzung zum SOP Management. Die digitalen Preozesse setzen neue Maßstäbe in der „Training Compliance“.
LERNERFOLG
Wenn „Gelesen und Verstanden“ nicht ausreicht, wird der Lernerfolg am Ende der SOP Closed Loop Prozesse kontrolliert.
ABWEICHUNGEN
Systematische und kontrollierte Dokumentation, Analyse und Behebung von Abweichungen zur Verbesserung der Qualität und Einhaltung von Vorschriften.
REKLAMATIONEN
Ob vom Kunden, gegenüber Lieferanten oder interner Natur – Reklamationen werden kontrolliert gelenkt. Dies mit einem Höchstmaß an regulatorischer (Prozess-) Sicherheit.
ÄNDERUNGEN
Die Control System Prozesse gewährleisten eine präzise Steuerung und Kommunikation von Änderungen jeglicher Art. Vom Anfang bis zum Ende.
Ihr Informationspaket zum Trial Master File
Erhalten Sie einen Eindruck von diesem und weiteren Produkten oder lesen Sie, welche Erkenntnisse wir aus der Forschung und Entwicklung gewonnen haben. Nutzen Sie unsere exklusiven Inhalte wie Whitepaper oder Studienergebnisse rund um die Digitalisierung der Qualitäts- und Compliance-Prozesse. Stellen Sie sich einfach und bequem Ihre gewünschten Medien zusammen.
Wissenswertes | News | Aktuelles
Weleda setzt auf die Cloud-Lösung der DHC Business Solutions zur weiteren Digitalisierung der GxP-Dokumentation
Die Weleda AG, weltweit führend in zertifizierter Naturkosmetik und anthroposophischen Arzneimitteln, hat im Rahmen ihrer...
Digitale Transformation des Qualitätsmanagement beim Blutspendedienst des Bayerischen Roten Kreuzes mit DHC VISION
Der Blutspendedienst des Bayerischen Roten Kreuzes (BSD) hat 2023 erfolgreich die Softwarelösung DHC VISION eingeführt, um seine...
RegTech Insights: DHC VISION eTMF: Mit dem digitalen Prüfarztordner (eISF) Patientendaten sicher verwalten
Das Managementsystem DHC VISION unterstützt klinische Studien mit einem digitalen Trial Master File (eTMF). Jetzt wurde die Lösung um den...
Electronic Trial Master File – FAQ
Was ist ein Trial Master File?
Spätestens mit der Diskussion um die Zulassung von Corona-Impfstoffen ist der breiten Öffentlichkeit der Begriff „Klinische Studie“ bekannt. Eine Klinische Studie überprüft die Leistung, Wirksamkeit und Sicherheit von Medizinprodukten, Behandlungsformen, Wirkstoffen etc. und wird mit Patienten oder Probanden durchgeführt.
Das Trial Master File (TMF) ist eine Sammlung von Dokumenten aus einer klinischen Studie. Im TMF sind alle wesentlichen Akten der Studie zusammengefasst, während gleichzeitig die Integrität der klinischen Daten und die Compliance zur GCP sichergestellt werden.
Bei einer klinischen Studie wirken in der Regel zusammen: Das forschende Unternehmen (Sponsor), das sein Produkt für die Zulassung auf Leistung, Wirksamkeit und Verträglichkeit prüfen lässt; ein Auftragsforschungsinstitut (Contract Research Organization – CRO), das die Studie im Sponsor-Auftrag durchführt sowie eine oder mehrere klinische Einrichtungen (Investigator), die die Prüfung nach geltenden Standards und gemäß Studienplan durchführen. Pro Klinische Studie entsteht ein TMF.
Welche Regulierungen und Standards sind für ein TMF relevant?
Die GCP – Good Clinical Practice – definiert einen international anerkannten und nach ethischen und wissenschaftlichen Gesichtspunkten aufgestellten Standard für Planung, Durchführung, Monitoring/Auditierung, Dokumentation, Auswertung und Berichterstattung von Klinischen Studien. Der Inhalt eines TMF wird in der EU-Richtlinie 2005/28/EG geregelt.
Relevante Regulierungen der Europäischen Arzneimittel Agentur (EMA) sind: Guideline on the content, management and archiving of the clinical trial master file (paper and/or electronic), (EMA/INS/GCP/856758/2018); Guideline for good clinical practice E6(R2), Step 2b (EMA/CHMP/ICH/135/1995); Guideline for good clinical practice E6(R2), Step 5 (EMA/CHMP/ICH/135/1995).
Die Struktur einer klinischen Studie und die entsprechende Dokumentation wird im Referenzmodell TMF der Drug Information Association (DIA) festgelegt.
Was sind Herausforderungen in Verbindung mit TMFs? Hilft Digitalisierung?
Die besonderen Herausforderungen bei TMFs liegen:
- in der Zahl der beteiligen Personen/Organisationen (Sponsor, CRO, Investigators) und deren unterschiedlichen Aufgaben und Interessen;
- in der Vielzahl und Heterogenität der Daten und Dokumente, ihrer Vollständigkeit, Wiederauffindbarkeit, Versionierung, Verfügbarkeit und regulatorisch konformen, auditierbaren Ablage bzw. Dokumentation;
- in Medienbrüchen zwischen analogen, z.T. handschriftlichen, und digitalen Daten, die in klinischen Studien entstehen und sich u.a. aufgrund des geringen Digitalisierungsgrads nicht konsolidiert darstellen lassen;
- in der fehlenden Integration verwandter IT-Systeme bei Sponsor, CRO und Investigator und damit in einer heterogenen und redundanten Systeminfrastruktur, die den durchgängigen Datenaustausch behindern.
Dadurch werden die Durchführung bzw. Dokumentation einer Studie tendenziell schwierig, ihre Überprüfung (Audit) durch Regulierungs- und Zulassungsbehörden erschwert und die regulatorisch konforme Archivierung gefährdet.
In Auditberichten von Regulierungsbehörden finden sich daher regelmäßig Beanstandungen des regulatorisch konformen TMF-Managements und der nachvollziehbaren Dokumentation von Studien. Viele dieser Herausforderungen können durch Digitalisierung der Prozesse und durch entsprechende KI-Unterstützung in einem eTMF bewältigt werden. Das Forschungsprojekt NextGenTMF arbeitet unter Federführung der DHC an einer entsprechende Lösung. Nähere Informationen dazu finden Sie hier.